近日,中国科学院合肥物质院健康所谷红仓、张帆基因组学团队在癌症研究经典期刊《Molecular Cancer》上发表了题为“Integrative Multi-Omics Analysis Reveals the lncRNA 60967.1–PLCD–ATRA Axis as a Key Regulator of Colorectal Cancer Progression and Immune Response”的研究论文。该研究通过多组学综合分析揭示了一个新的lncRNA-mRNA/蛋白质-代谢物网络,在结直肠癌(CRC)进展和免疫调节中发挥着关键作用,为提高治疗效果提供了有前景的治疗靶点。
CRC具有显著的遗传和表观遗传异质性,凸显了对新型治疗靶点的需求。尽管免疫疗法在癌症治疗中取得了显著进展,但约85%的结直肠癌患者由于不同的遗传和表观遗传特征表现出耐药性。多组学方法通过整合基因组学、蛋白质组学和代谢组学的数据,成为阐明疾病机制的有力工具。
研究团队对来自CRC组织和配对正常邻近组织的转录组学、蛋白质组学和代谢组学数据进行了综合分析。发现了差异表达的1394个长非编码RNA(lncRNA)、2788个mRNA、548个蛋白质和91个代谢物。进一步,识别出了一个显著的相互作用网络,包括22个lncRNAs、14个mRNAs/蛋白质和9个代谢物,其中,lncRNA 60967.1在该网络中起关键调控作用。功能验证显示,lncRNA 60967.1在CRC细胞系和患者组织中显著下调,lncRNA 60967.1的过表达恢复了肿瘤抑制基因PLCD4的表达,并提高了全反式视黄酸(ATRA)的水平。这一调节增强了IFN-γ诱导的凋亡,并增加了IFN-γ受体亚单位IFNGR1的表达,从而部分逆转了IFN-γ抗性。在小鼠模型中,lncRNA 60967.1的过表达促进了免疫细胞的浸润,并与抗PD-1治疗协同抑制了肿瘤生长。
总之,通过转录组学、蛋白质组学和代谢组学等多组学数据的分析,本研究识别出了一个涉及lncRNA、PLCD4、ATRA和PD-L1的CRC新型调控网络。lncRNA 60967.1-PLCD4-ATRA轴在免疫反应和肿瘤进展的调节中起到了重要作用。该调控轴的临床相关性在于,它有可能改善治疗效果,特别是在目前治疗耐药的患者中。靶向该轴可能成为一种增强CRC免疫治疗效果的治疗策略,进一步的研究可能揭示其作为治疗反应生物标志物的潜力。
中国科学院合肥物质院研究员谷红仓、研究员张帆、博士后赵宁宁和浙江大学邵逸夫医院戴胜医生为该论文的并列通讯作者。该项研究得到了国家科技重大专项、国家自然科学基金、中国科学院上海应用物理研究所种子基金、浙江省重点研发计划、2023年省部共建重点项目的支持。
文章链接:https://link.springer.com/article/10.1186/s12943-025-02359-x
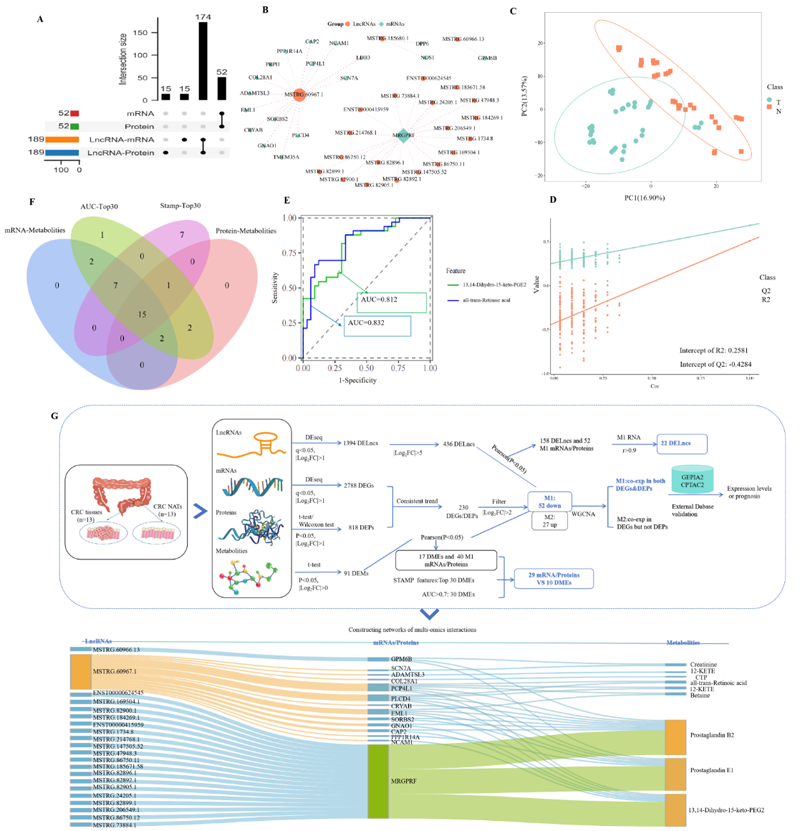
综合多组学分析揭示了lncRNA、mRNA、蛋白质和代谢物之间的网络关联
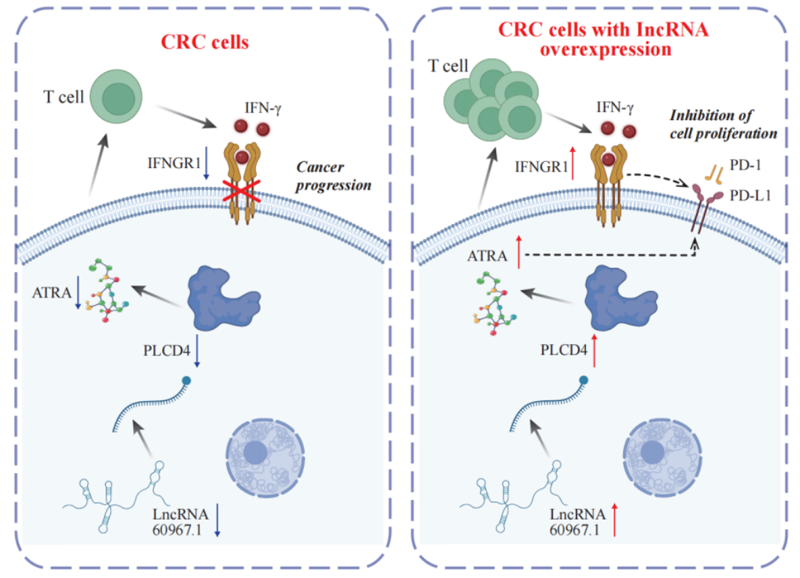
lncRNA 60967.1在调节PLCD4/ATRA轴及抗PD-1治疗中发挥重要作用,调控免疫反应并影响结直肠癌(CRC)进展的模式图
关于Molecular Cancer:
Molecular Cancer 是一本开放获取、同行评议的国际学术期刊,由 BioMed Central 出版社发行,创刊于2002年。2024年影响因子为 33.8;中国科学院分区中位于医学1区(生化与分子生物学、肿瘤学均为 1区)。该期刊专注于从分子角度探讨癌症及相关生物医学领域的研究,涵盖基础、转化和临床研究,旨在推动癌症的理解、预防、诊断和治疗。其 ISSN为1476-4598,出版周期为月刊,官方网站为 http://molecular-cancer.biomedcentral.com