近日,中国科学院合肥物质院健康所/合肥肿瘤医院王宏志研究员、洪波研究员与中国科学技术大学附属第一医院王伟研究员合作,通过对小细胞肺癌患者肿瘤组织DNA和血液游离DNA(cfDNA)的甲基化组整合分析,发现RASA4基因的表观遗传沉默促进小细胞肺癌化疗耐药以及转移。研究成果以题为“Integrated methylome analysis identifies an epigenetically silenced tumor suppressor RASA4 in small cell lung cancer”发表于国际权威期刊Communications Biology(中科院一区TOP,IF=5.1)。王宏志研究员、洪波研究员和王伟研究员为论文的通讯作者,博士研究生符萌为论文第一作者,中国科学院合肥肿瘤医院为第一完成单位和通讯作者单位。
小细胞肺癌恶性程度高、预后差,患者常在初始化疗敏感后迅速出现耐药与疾病进展,而DNA甲基化介导的表观遗传调控在该过程中的作用尚不明确。研究团队通过DNA甲基化免疫共沉淀测序(MeDIP-seq)技术,对小细胞肺癌组织DNA与血浆cfDNA进行了甲基化组图谱分析,发现RASA4基因启动子区域在肿瘤组织DNA及进展期患者cfDNA中均呈现显著的高甲基化状态。进一步通过药物及靶向去甲基化干预,可在小细胞肺癌细胞系中重新激活RASA4的表达。功能研究表明,作为Ras信号的负调控因子,RASA4表达下调会激活Ras-MAPK信号通路;过表达RASA4显著抑制小细胞肺癌细胞的增殖、侵袭与化疗耐药;而敲低RASA4则通过促进上皮‑间质转化(EMT)与肿瘤干细胞特性增强其恶性表型。研究进一步发现RASA4负调控EMT相关蛋白SERPINE2,并与之存在直接相互作用。临床免疫组织化学分析证实,RASA4在小细胞肺癌组织中的表达显著降低,且其低表达与患者的不良预后密切相关。
总之,该研究发现RASA4基因的表观遗传沉默是驱动小细胞肺癌恶性进展的关键机制。该基因沉默通过激活Ras-MAPK信号通路、诱导EMT及肿瘤干细胞特性,促进肿瘤侵袭、转移与化疗耐药。该研究为小细胞肺癌的诊断与治疗提供了新的生物标志物和干预靶点。
该研究得到了国家自然科学基金、安徽省临床医学研究转化专项、中国科学院合肥大科学中心协同创新培育基金、“科大新医学”联合基金等项目的资助。
文章链接:https://www.nature.com/articles/s42003-025-09440-7
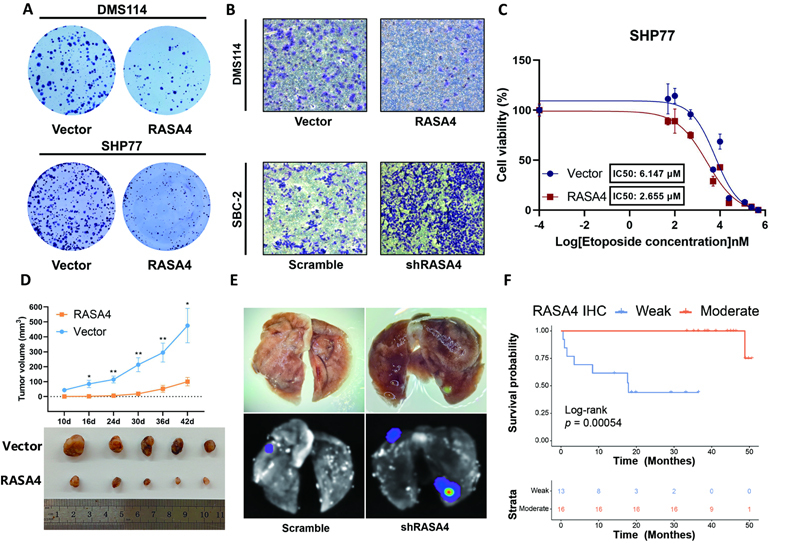
图:RASA4表观遗传沉默促进小细胞肺癌增殖、侵袭与化疗耐药,导致患者临床预后不良。